アデノシン産生阻害関連抗体の可能性-BP1200とBP1210の市場環境
今回のブライトパス通信では、抗体医薬パイプラインのBP1200(抗CD73抗体)とBP1210の市場環境と競争力の源泉について説明します。
先日、当社ホームページで当社のビジネスモデル、市場環境、競争力の源泉、事業計画、リスク情報をまとめた資料を開示しました(「事業計画及び成長可能性に関する事項」)。この資料の中でBP1200とBP1210を説明していますが、ここではBP1200とBP1210についてさらに踏み込んで説明したいと思います。
BP1200 (CD73抗体)は、腫瘍中の細胞外アデノシン産生を阻害して腫瘍環境を改善する機能性抗体です。アデノシンは細胞間メッセンジャーとしての生理活性を持つ生体分子ですが、がんでは腫瘍に浸潤した免疫細胞の抗腫瘍作用を著しく減弱させます。そこで、アデノシンを産生する細胞外酵素のCD73を阻害して、がんを攻撃する免疫細胞を活性を持続させるのが狙いです。腫瘍環境を改善して免疫細胞の抗腫瘍活性を間接的に上昇させるので、PD-1/PD-L1抗体などの免疫チェックポイント分子阻害薬との併用効果も期待することができます。免疫チェックポイント分子阻害薬は化学療法や分子標的薬よりも広範ながん種に適用でき生存率も高めることができますが、十分な臨床効果が得られる患者は10-30%程度にとどまります。そのため、免疫チェックポイント分子阻害薬の有効性を高める医薬品や治療法の開発が非常に活発に進められています。様々ながん種の腫瘍を病理解析して腫瘍の免疫反応状態を調べると、免疫細胞が腫瘍内部までよく浸潤しているタイプ、免疫細胞が腫瘍の周りにとどまって内部に到達できていないタイプ、腫瘍に免疫細胞が存在してないタイプなどがあり、がん免疫が十分な効果を発揮できない原因も多様であることがわかってきました。そこで、様々な科学的根拠と仮説にもとづいて臨床試験が計画されて、実施数は年々増加しています(図1)。
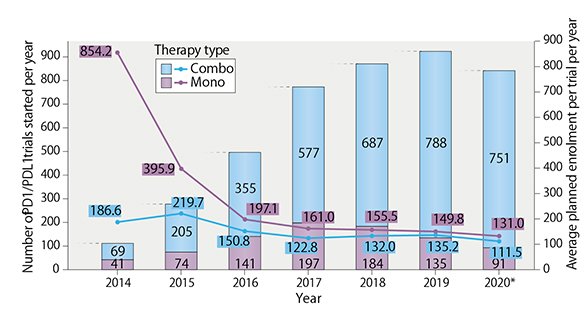
図1、引用元Nature Reviews Drug discovery (10.1038/d41573-020-00204-y)。 2020年は3Qまでの合計。
アデノシン産生の阻害は、免疫チェックポイント分子阻害と並んで現在期待されるがん免疫の活性化ターゲットです(図2)。
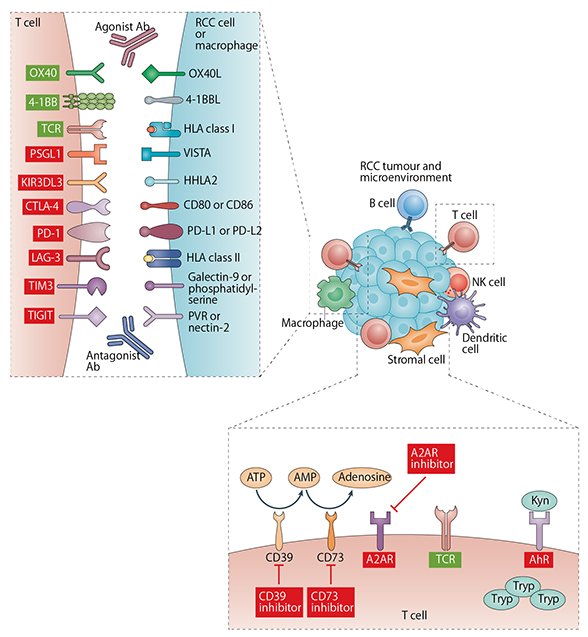
図2、Nature Reviews Clinical Oncology (10.1038/s41571-020-00455-z)引用
CD73抗体をはじめとして、アデノシン産生阻害薬やアデノシンシグナリング阻害薬はベンチャー企業が開発し大手製薬メーカーに盛んにライセンスアウトされています。特に抗体は、脳に到達しないことや細胞内の分子を阻害しないことから低分子薬よりも毒性が現れにくく、腫瘍の細胞外アデノシン産生を選択的に阻害することに適しており臨床開発にはプラスに働きます。
これまでのライセンシングとパートナーリングは、第1相試験の開始直前が目立ち、その取引総額も大きな規模になっています(図3)。

図3、個人投資家向け会社説明会資料 (p33) 2021年12月4日
アデノシン産生阻害抗体は、MedImmune社が開発したCD73抗体(オレクルマブ)をアストラゼネカ社が臨床開発を進めていますが、アストラゼネカ社はさらにフランスのInnate Pharma社からCD39抗体を非臨床段階で導入し、アデノシン産生阻害薬に一層注力しています。9月のESMO2021学会では、当社のCD73抗体(BP1200)に関する発表が表彰されましたが、アストラゼネカ社はオレクルマブとPD-L1抗体(デュルバルマブ)を併用する第2相試験(COAST試験)で非常に良好な臨床結果を報告してアデノシン産生阻害の臨床有効性を強く示唆しました。この約1年の間にカリフォルニアのArcus社(アデノシン阻害低分子薬)やI-MAB社等から臨床データが報告され始め、アデノシン産生阻害の治療コンセプトと臨床効果の科学的データが蓄積しており、CD73に対する注目度はより高まっています。BP1200は、来期に動物試験およびCMC関連試験を実施して開発を進める予定です。
TIM-3は、TIGITやCD47と並んでPD-1/PD-L1に続く次世代の免疫チェックポイント分子です。T-cell immunoglobulin and mucin domain-3の名前の通り、T細胞や樹状細胞などの免疫細胞に発現して免疫に抑制的に働きます。本来TIM-3は、過剰な免疫反応や炎症反応を抑える役割を持ちますが、進行したがんに対してはTIM-3の抑制機能を阻害してがん免疫の抗腫瘍効果を高めます。腫瘍に浸潤したT細胞はがん細胞を攻撃するたびに、がん細胞から抑制の刺激をPD-1やTIM-3を介して受けて抗腫瘍活性を失った機能不全状態に陥ります。この状態をT細胞の疲弊と呼び、攻撃に疲れて燃え尽きた状態になりますが、T細胞は完全に疲弊するともはや再活性化することはできません。そこで、抗TIM-3抗体でがん細胞から抑制の刺激をブロックし、T細胞の疲弊を抑えて活性化状態を維持することでがんへの攻撃力を強めます。TIM-3抗体によるT細胞の疲弊抑制は、PD-1/PD-L1抗体によるがん免疫亢進のコンセプトと共通点が多くPD-1/PD-L1抗体との併用効果も期待されているため、免疫チェックポイント阻害抗体の薬事承認に伴って、大手の製薬企業とバイオテック企業がTIM-3抗体の自社開発と臨床試験を進めています(図4)。
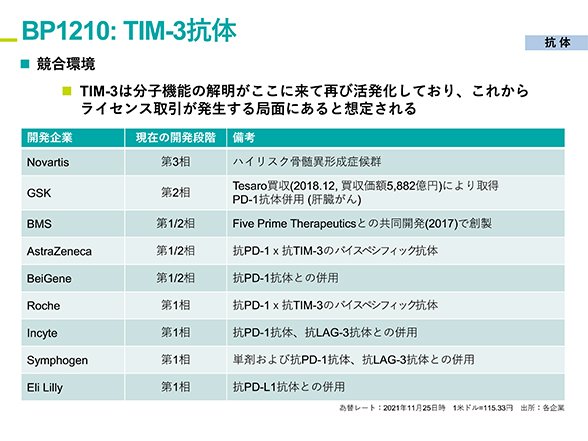
図4、個人投資家向け会社説明会資料 (p37) 2021年12月4日
T細胞が発現するPD-1はがん細胞が発現するPD-L1と相互作用することで活性抑制の信号をT細胞に伝えます。すわなちPD-L1はPD-1のリガンドです。同様にTIM-3にもリガンドが存在し、そのリガンドとの相互作用によってT細胞を抑制します。TIM-3のリガンドはホスファチジルセリン、CEACAM、HMGB1、galectin-9の4種が知られていますが(図5)、特に注目されているのがgalectin-9です。galectin-9はがん細胞や抑制性T細胞(Treg)などから分泌されて、TIM-3に結合するとT細胞の機能を抑制しアポトーシス(細胞死)を誘導します。
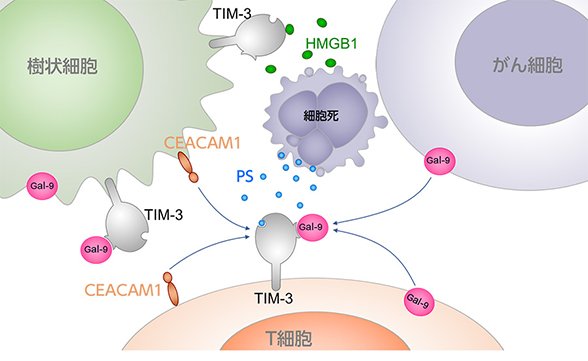
図5、参考:当社ホームページ
これまで臨床試験に進んだTIM-3抗体はホスファチジルセリンによるT細胞抑制はブロックすることはできますが、galectin-9によるT細胞抑制をブロックできません。そのため、先行するTIM-3抗体では臨床効果が限定的である可能性が常に指摘されています。当社のTIM-3抗体(BP1210)は、二重特異性抗体技術を利用してgalectin-9を含むリガンド群を網羅的に阻害することが可能です。この点は他社のTIM-3抗体との最も大きな違いです。さらに、二重特異性抗体技術を応用してT細胞の疲弊関与分子との二重特異性抗体の創製にも着手するなど、研究開発を推し進めています。
ごく最近、樹状細胞上に発現するTIM-3ががん免疫に大きな役割を持つという知見がNature(doi:10.1038/s41586-021-03626-9)に公表されました。PD-1/PD-L1も同様に樹状細胞上での機能が示唆されています。がん細胞によるT細胞の抑制に関わる分子群が樹状細胞によるT細胞のダウンレギュレーションに関わるという点と、TIM-3による樹状細胞の抑制メカニズムが詳細に解析された点でとても興味深い報告です。樹状細胞によるT細胞のダウンレギュレーションはがん免疫治療で今とてもホットな話題ですので、また次の機会に説明したいと思います。
どうぞよいお年をお迎えください。