抗TIM-3抗体の可能性-BP1210の特徴
前回のブライトパス通信で当社抗体医薬パイプラインの外部環境と科学的背景を記載しました。今回はその続きとして、抗体医薬パイプラインBP1210の特徴をさらに一歩踏み込んで記載します。
今日のがん免疫療法を切り開いた免疫チェックポイント阻害抗体は様々ながんに対する有効性が確かなものになりました。がん細胞を殺傷するキラーT細胞が抑制されることをブロックして抗腫瘍作用を高める薬効メカニズムも医学的に広く浸透しています。キラーT細胞は「はたらく細胞」の精悍で武闘派のイメージの通り、がん細胞を認識して直接殺傷する攻撃型の細胞ですが、その活動は抑制機構によってコントロールされています。正常な組織でキラーT細胞が活躍する必要は無く、むしろその高い攻撃力が正常組織を誤って破壊してしまうのを避けるためです。がん細胞はこの抑制機構を利用してキラーT細胞を不活性化して攻撃から逃れ、増悪します。そこで、がん細胞が抑制機構を利用できないようにキラーT細胞上の抑制機構を覆い隠すのが免疫チェックポイント阻害抗体です。この画期的な発見には2018年にノーベル生理学・医学賞が授与されました。そのノーベル賞からまだ3年強ですが、科学と医学はさらに進み、今日では新たなメカニズムが提唱されています。今回のブライトパス通信では、その背景とともに抗体医薬パイプラインの特徴を樹状細胞によるT細胞のダウンレギュレーションに焦点を当てて説明します。
がんに対する免疫は、1) 樹状細胞が腫瘍の死細胞を捕捉して、2) がん抗原をT細胞に提示し、3) がんに対するT細胞を活性化、4-5) 活性化したT細胞が腫瘍病巣に移行して腫瘍内に浸潤、6) がん細胞を認識して7)攻撃殺傷し、攻撃された死細胞がまた樹状細胞に捕捉される(1に戻る)を繰り返します(図1)。
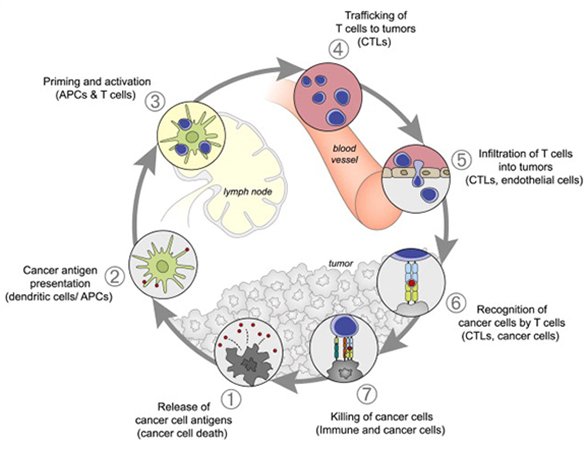
図1 Immunity (2013) 10.1016/j.immuni.2013.07.012から抜粋
これは米国の研究者が2013年に提唱した免疫による抗腫瘍メカニズムで、ステップ7でT細胞ががん細胞を殺傷した際に、がん細胞が抑制分子(緑色)をT細胞に提示してT細胞の活性を減弱させます。免疫チェックポイント阻害抗体はこの抑制機構をブロックしてT細胞の殺傷攻撃を促進すると考えられてきましたが、興味深いことに、ごく最近の研究で免疫チェックポイント阻害抗体は樹状細胞をターゲット(ステップ3)にしてがん抗原特異的T細胞を活性化することが示されています。
BP1210の薬剤標的であるTIM-3は、T細胞ががんを攻撃すると自己抑制のためにT細胞に発現します(ステップ7)。当社ウェブサイトでも図解していますが、BP1210はTIM-3によるT細胞の自己抑制をブロックしてがんに対する殺傷力を持続させます。従って、TIM-3阻害による抗腫瘍効果はPD-1/L1に対する免疫チェックポイント阻害薬と類似したコンセプトと言えます。しかしその一方、TIM-3はPD-1/L1とは異なり複数のリガンドが存在します(フォスファチジルセリン、HMGB1、CEACAM、galectin-9など)。他社が開発中のTIM-3抗体は一部のリガンドだけしかブロックできず効果が部分的であるのに対し、BP1210は複数のリガンドを同時にブロックできる点が他社開発品との大きな違いであることを前回のブライトパス通信で記載しました。さらにここで注目する点は、TIM-3はT細胞だけではなく、樹状細胞でも機能していることです。TIM-3は発見以来、T細胞での機能に特に焦点が当てられてきました。臨床試験中のTIM-3抗体もT細胞の活性促進(ステップ7)を薬効コンセプトとして開発されています。しかし現在では、TIM-3は、樹状細胞による免疫誘導(ステップ3)を抑制していると考えられています。
樹状細胞は、がんや病原体などの異物の分子構造パターンを識別して免疫を誘導する指令細胞です。異物構造を認識する様々な受容体(Toll様受容体、NOD様受容体、RIG様受容体、C型レクチン様受容体など)を発現して病原体やがんの死細胞などを認識し、それらに特異的なT細胞を活性化します。ヒトにはToll様受容体は10種類、NOD様受容体は20種類以上の遺伝子があり様々な異物を認識することが可能です。NOD様受容体の一部は、特にインフラマソームと呼ばれ、免疫反応の誘導と促進に重要な役割を果たしていることがわかっています。昨年、TIM-3を発見したHarvard Medical Schoolの研究者らによって、TIM-3はインフラマソームを介して樹状細胞による免疫の誘導を制御していることが明らかにされました (Nature 2021, doi:10.1038/s41586-021-03626-9)。樹状細胞のTIM-3を破壊するとT細胞がより活性化されて抗腫瘍効果が増強するのですが、T細胞のTIM-3を破壊した場合よりも増強効果が圧倒的に高く、樹状細胞のTIM-3ががん免疫の機能本体であると言わんばかりのデータです。T細胞を中心に進められたこれまでのTIM-3研究は何だったのかということにもなりますが、興味深いことは、これまでのTIM-3阻害薬では樹状細胞上のTIM-3の機能をブロックできないことです。当社は独自の工夫でTIM-3を効果的に抑制することを可能にしており、既存のTIM-3阻害薬との大きな違いを創出しています。TIM-3は樹状細胞によるがん特異的T細胞の活性化と、そのT細胞によるがん細胞の殺傷攻撃の二段階を抑制する免疫チェックポイント分子であることがわかってきました。この二段階をともに促進することで免疫を持続的に強く惹起し、既存薬よりも高い抗腫瘍効果が得られることが期待されます(図2)。
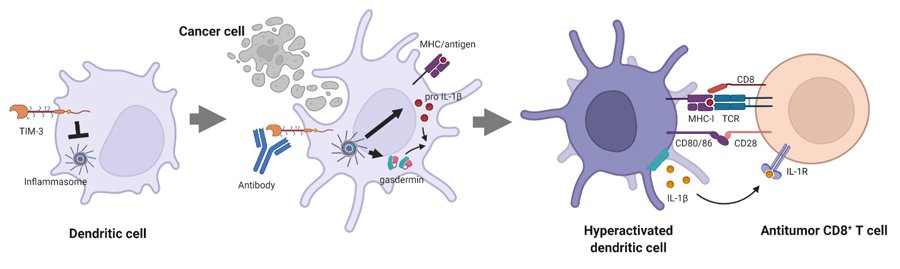
図2 TIM-3による抑制の解除による樹状細胞を介した強力な免疫誘導
話が少し変わりますが、抗体医薬品の先駆けであるハーセプチン(抗HER2抗体)の抗腫瘍活性の機序は、様々の基礎研究の一方で不明な点が多く残されたまま開発が進み、臨床開発と並行した医薬研究で作用機序が細胞増殖抑制と抗体依存性細胞傷害(ADCC)の複合的作用と推定されました。免疫チェックポイント分子の阻害による抗腫瘍効果も、がん細胞によるT細胞の抑制阻害のみならず、樹状細胞によるT細胞の活性化促進が提唱され、作用機序の理解とそれに基づくがん免疫治療薬の開発は新たな段階に進んでいます。
当社抗体パイプラインは、本年の国際会議でも公表される予定ですので、随時ウェブサイトに掲載します。
付記:免疫チェックポイント阻害抗体薬にはPD-1/L1を標的とした抗体(キートルーダ、オプチーボ、テセントリクなど)とCTLA-4を標的とした抗体(ヤーボイなど)がありますが、本稿ではPD-1/L1を標的とした抗体を対象に記載しています。CTLA-4を標的とした抗体は樹状細胞によるT細胞の活性化(ステップ3)を増強することが知られています。CTLA-4を標的とした抗体は、現在ではステップ7で制御性T細胞の抑制している可能性も指摘されています。