IRCI2025における二重特異性抗体BP1212の非臨床データの発表について
去る2025年6月18日から20日にかけて、フランスのリヨンで、がんと感染症における免疫反応をテーマとする学会Immune Response in Cancer and Infection("IRCI")2025が開催され、当社はCD39×TIM-3二重特異性抗体BP1212の非臨床試験データを発表しました。
-BP1212が働きかける自然免疫
免疫システムは、自然免疫と獲得免疫の2段構えになっています。自然免疫は、生まれながらに備わった即時的な防御機構であり、病原体や異物に対して最初に反応します。一方、獲得免疫は、さまざまな病原体やがん細胞との接触を通じて後天的に形成され、自然免疫による防御を突破された場合に発動し、より特異的で持続的な免疫応答を担います。がんは、この免疫システムの働きを巧みに回避・抑制する能力を備えており、免疫の監視をすり抜けて増殖することが知られています。
近年の研究により、がん細胞を排除する獲得免疫主体の"がん免疫応答"も、ワクチンと同様に自然免疫の活性化と密接に連動していることが明らかになっています。特に、がん局所における自然免疫すなわち炎症反応が、T細胞をはじめとする獲得免疫の効果的な誘導に不可欠であり、抗腫瘍効果を最大限に引き出す鍵となります。
-インフラマソームvs CD39&TIM-3
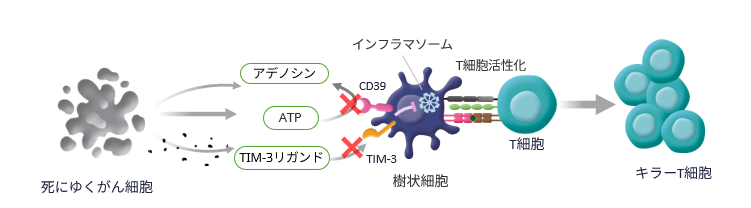
この自然免疫の中心的役割を担うのが、インフラマソームと呼ばれる細胞内のタンパク質複合体です。インフラマソームは、病原体や細胞損傷を感知し、炎症反応を引き起こします。樹状細胞ががん局所でがん抗原を取り込み、T細胞に抗原提示を行って免疫応答を誘導するには、樹状細胞内のインフラマソームの活性化による自然炎症の誘導が重要なステップと考えられています。
しかしながら、樹状細胞の表面に発現するCD39およびTIM-3がこのプロセスを阻害していることが、近年の研究で明らかになってきました。CD39は、インフラマソーム形成を促進する細胞外ATPなどの分子を分解・変換し、TIM-3は細胞内に抑制性シグナルを伝達することで、いずれもインフラマソームの活性化を抑制します。これらの分子は樹状細胞の活性化を制御し、がん免疫応答の抑制に関与しています。
-BP1212の今後の展望
BP1212は、このCD39およびTIM-3の両方に結合し、それぞれの免疫抑制機能を同時にブロックすることで、樹状細胞の活性化を促進し、獲得免疫の誘導を後押しします。とりわけ、インフラマソーム形成の"ブレーキ"を解除し、その活性化を促進するという作用機序を有する点で、BP1212は世界でも類を見ない新規メカニズムを持つ治療用抗体であり、「ファースト・イン・クラス」となり得る可能性を秘めた有望な医薬品候補です。